การไทเทรต คือ กระบวนการทางเคมีเพื่อวิเคราะห์หาปริมาณสารที่เราไม่ทราบ โดยมีอุปกรณ์ คือ
1. สารละลายที่ทราบความเข้มข้นแน่นอน หรือสารละลายมาตรฐาน(Standard Solution)
2. บิวเรตต์ หรือเรียกอีกอย่างว่า ไทแทรนต์ (titrant)
3. ขวดรุปชมพู่ หรือฟลากส์ (Flask)
ในการไทเทรตนั้น เราจะนำสารละลายมาตรฐาน ใส่ในบิวเรตต์ และใส่สารละลายที่ไม่ทราบปริมาณ ในฟลาสก์ โดยเราจะต้องกำหนดปริมาตร เพื่อจะสามารถคำนวณได้ด้วย
จากนั้น เราก็จะค่อยๆหยดสารละลายมาตรฐานจกบิวเรตต์ลงไปในสารละลายที่ไม่ทราบปริมาณ จนถึงจุดที่สารทั้งสองทำปฏิกริยากันพอดี เรียกจุดนั้นว่า จุดสมมูล ซึ่งต้องหาทุกครั้งในการไทเทรต เพื่อจะคำนวณหาค่าปริมาณสารที่ไม่ทราบค่า
การไทเทรตกรด-เบส
ในการไทเทรตกรดและเบสนั้น จุดสมมูลของกรด-เบส แต่ละคู่นั่น จะมีค่า pH ไม่เท่ากัน ซึ่งเราสามารถวัดได้ด้วยการใช้ pH meter หรือการเขียนกราฟไทเทรต เมื่อหาจุดสมมูลได้แล้ว ก็จะนำไปเลือกอินดิเคเตอร์สำหรับการไทเทรตเพื่อหาความเข้มข้นของกรดหรือเบสที่ไม่ทราบค่า โดยจุดที่อินดิเคเตอร์เริ่มเปลี่ยนสี จะเรียกว่า จุดยุติ โดนในการไทเทรตนั้น เราจะต้องหาอินดิเคเตอร์ที่มีจุดยุติใกล้เคียงกับจุดสมมูลมากที่สุด เพื่อจะสามารถคำนวณค่าปริมาณได้ใกล้เคียงกับจุดที่สารทั้งสองทำปฏิกริยากันพอดีนั่นเอง
ในการไทเทรตนั้น เราจะต้องหาค่า pH 4 จุดระหว่างการไทเทรต ได้แก่ จุดเริ่มต้น, ก่อนถึงจุดสมมูล, ที่จุดสมมูล และ เกินจุดสมมูล
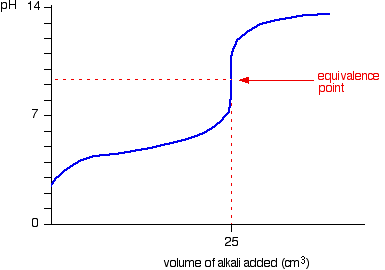
การไทเทรตกรดแก่กับเบสแก่
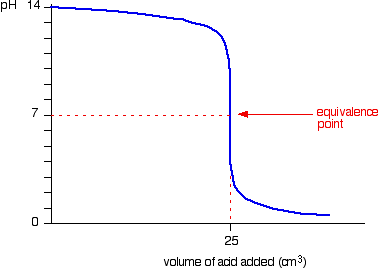
ตัวอย่างเช่น NaOH + HCl ----------> NaCl + H2O กำหนด HCl เป็นสารละลายไม่ทราบปริมาณ
เราจะได้กราฟ คือ
ก่อนการไทเทรตนั้น มีแต่ NaOH อยู่ ค่า pH จึงเป็นของ NaOH เท่านั้น
ก่อนถึงจุดสมมูล NaOH หมดไปบางส่วนกับการทำปฏิกริยากับ HCl ค่า pH จึงเป็นค่า pH ของ NaOH ที่เหลืออยู่
ที่จุดสมมูล เกิด NaCl ซึ่งเป็นเกลือกลางอย่างเดียว จึงมี pH=7
เกิดจุดสมมูล เหลือ HCl แต่ NaOH หมด ค่า pH จึงเป็นค่า pH ของ HCl ที่เหลืออยู่
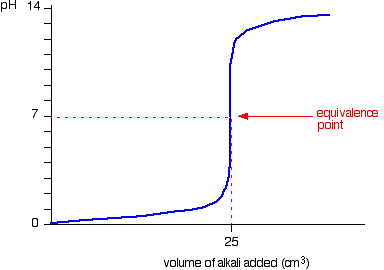
หรือถ้าเรากำหนด NaOH เป็นสารละลายไม่ทราบปริมาณ จะได้ กราฟ คือ
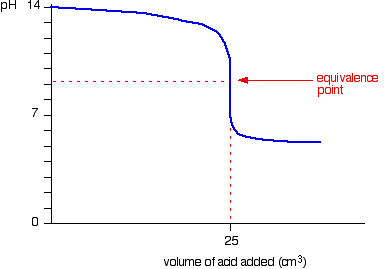
การไทเทรตกรดแก่กับเบสอ่อน
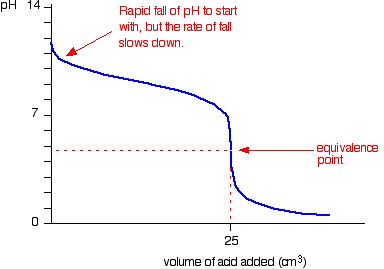
ตัวอย่างเช่น NH3 + HCl ----------> NH4Cl กำหนด HCl เป็นสารละลายไม่ทราบปริมาณ
ได้กราฟ คือ
ก่อนการไทไทรต ค่า pH เกิดจาก NH3 อย่างเดียว
ก่อนถึงจุดสมมูล HCl หมด เกิด NH4Cl บางส่วน ค่า pH จึงเกิดจากสารละลายผสม NH3 และ NH4Cl คือสารละลาย Buffer นั่นเอง
ที่จุดสมมูล เหลือสารเดียว คือ NH4Cl ซึ่งมีสมบัติเป็นกรด pH ที่จุดสมมูลจึงค่อนไปทางกรด
เกิดจุดสมมูล HCl เหลือ ค่า pH เกิดจาก HCl อย่างเดียวเท่านั้น
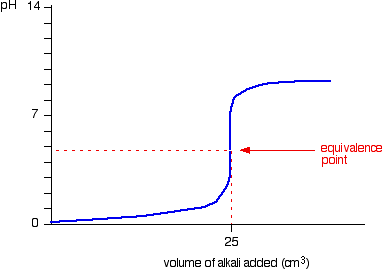
หรือถ้าเรากำหนด NH3 เป็นสารละลายไม่ทราบปริมาณ จะได้กราฟ คือ
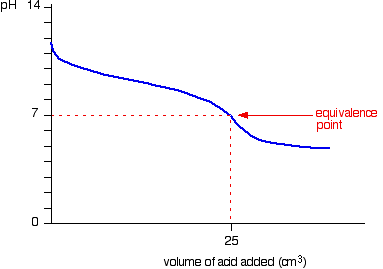
การไทเทรตกรดอ่อนกับเบสแก่
ตัวอย่างเช่น NaOH + CH3COOH ----------> CH3COONa + H2O กำหนด NaOH เป็นสารละลายไม่ทราบปริมาณ
จะได้กราฟ คือ
ก่อนการไทเทรต ค่า pH เกิดจาก CH3COOH อย่างเดียว
ก่อนถึงจุดสมมูล ค่า pH เกิดจากสารละลายผสม ระหว่าง CH3COOH กับ CH3COONa
ที่จุดสมมูล ค่า pH เกิดจาก CH3COONa อย่างเดียว
เกินจุดสมมูล ค่า pH เกิดจาก NaOH อย่างเดียว
หรือถ้าเรากำหนด CH3COOH เป็นสารละลายไม่ทราบปริมาณ จะได้กราฟ คือ
การไทเทรตกรดอ่อนกับเบสอ่อน
ตัวอย่างเช่น CH3COOH + NH3 ----------> CH3COONH4 กำหนด CH3COOH เป็นสารละลายไม่ทราบปริมาณ
จะได้กราฟ คือ
ก่อนการไทเทรต ค่า pH เกิดจาก NH3 อย่างเดียว
ก่อนถึงจุดสมมูล ค่า pH เกิดจากสารละลายผสม ระหว่าง NH3 กับ CH3COONH4
ที่จุดสมมูล ค่า pH เกิดจาก hydrolysis ของ CH3COONH4 อย่างเดียว แต่ที่ได้ pH = 7 เนื่องจาก Ka ของ CH3COOH และ Kb ของ NH3 มีค่าเท่ากันพอดี
เกินจุดสมมูล ค่า pH เกิดจากสารละลายผสม ระหว่าง CH3COOH กับ CH3COONH4
** เราจะเห็นว่า pH ไม่มีการเปลี่ยนแปลงอย่างรวดเร็ม และไม่มีกราฟลักษณะดิ่งในช่วงจุดสมมูล เราจึงไม่สามารถหาอินดิเคเตอร์มาใช้วัดได้ แต่ต้องใช้การวัดการนำไฟฟ้าด้วยเครื่องมือแทน**
Credit Graph : http://www.chemguide.co.uk/physical/acidbaseeqia/phcurves.html
Youtube Video :
Strong acid titration : http://www.youtube.com/watch?v=299o6c-Fkz4
Weak acid titration : http://www.youtube.com/watch?v=gbpc_JBG1F0
Performing a titration : http://www.youtube.com/watch?v=YDzzMcrdyB4
Titration Calculations : http://www.youtube.com/watch?v=BllRQAc76Y0