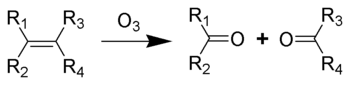
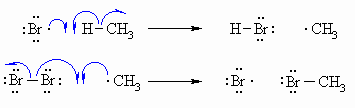
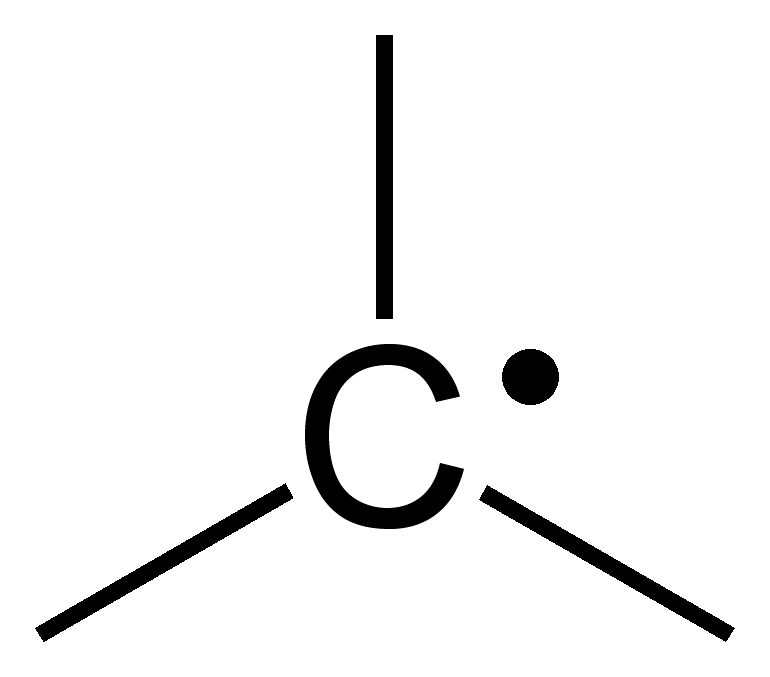
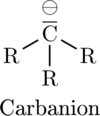
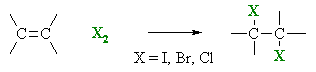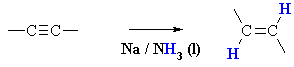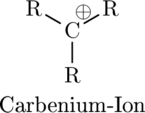Introduction
สารประกอบ Alkane มีสูตรเป็น CnH2n+2 ถ้าเป็นโซ่เปิด แต่ถ้าโว่ปิดจะเป็น CnH2n โดยสารประกอบ Alkane นั้นจะจับกันด้วยพันธะเดี่ยวทั้งหมด และสำหรับชื่อสารนั้น จะเรียกตามจพนวนคาร์บอนสายโซ่ที่ยาวที่สุด ตามตาราง
หมู่ Alkyl
หมู่ Alkyl ก็มาจาก Alkane นั่นแหละครับ แค่ H หายไปตัวนึง ทำให้สามารถไปสร้างพันธะกับหมู่อื่นๆได้ โดยการเรียกชื่อก็เหมือน Alkane เลย เพียงแค่เปลี่ยน -ane เป็น -yl เช่น Methyl (CH3), Ethyl (C2H5)
ข้อตกลง - คำนำหน้า (ทั้ง Alkane และ Alkyl)
1. n- ย่อมาจาก normal คือคาร์บอนต่อเป็นโซ่ตรงปกติ เช่น n-Hexane
2. iso- ใช้เมื่อมี Methyl แยกสาขาที่คาร์บอนตัวรองสุดท้าย เช่น isohexyl
3. ใช้ sec- นำหน้าเมื่อมีจุดต่อที่ Secondary Carbon (คาร์บอนที่มีหมู่ฟังก์ชันมาเกาะรอบๆ 2 ตัว)
4. ใช้ tert- นำหน้าเมื่อมีจุดต่อที่ Tertiary Carbon (คาร์บอนที่มีหมู่ฟังก์ชันมาเกาะรอบๆ 3 ตัว)
การเรียกชื่อ IUPAC
เป็นชื่อที่เรียกยากนิดนึง คนธรรมดาไม่เรียกกัน แต่ถ้าเรียกได้แล้ว จะสามารถทำนายสูตรโครงส้าง และเรียนรู้สารนั้นๆได้อย่างแม่นยำ
1. นับ C ที่ต่อกันยาวที่สุดเป็นโซ่หลัก
2. เริ่มนับตำแหน่งจากด้านที่มีหมู่ Alkyl มาเกาะมากที่สุด
3. บอกตำแหน่งพร้อมชื่อหมู่ Alkyl ที่มาเกาะ โดยใช้ขีดคั่นระหว่างตัวเลขกับตัวอักษร เช่น 2-methyl.....
4. เมื่อมีหมู่ Alkyl มาเกาะ 2 หมู่ขึ้นไป ให้เรียงตามตัวอักษรภาษาอังกฤษ โดยคำว่า mono, di, tri, tetra, sec, tert, และ n คำเหล่านี้ ข้ามไป ไม่เกี่ยวในการเรียงตัวอักษรเช่น n-hexane ก็เป็นตัว h
5. ถ้าหมู่ Alkyl เกาะที่คาร์บอนตัวเดียวกันก็เรียกกตำแหน่งนั้นซ้ำ
6. ถ้า Alkyl เกาะที่โซ่หลัก แต่ป็น Alkyl ประเภทเดียวกัน ใช้คำนำหน้า di. tri พวกนี้ โดยใช้จุลภาค ขั้นระหว่างตัวเลข เช่น 2,3-dimethyl.....
7. ถ้าเลือกโซ่หลักได้มากกว่า 1 ทาง เลือกทางที่มี Alkyl มาเกาะมากที่สุดถ้าเท่ากัน ก็ให้เลือกตำแหน่งที่มีผลรวมของตัวเลขทั้งหมดในโครงสร้างมีค่าน้อยที่สุด
ตัวอย่าง :